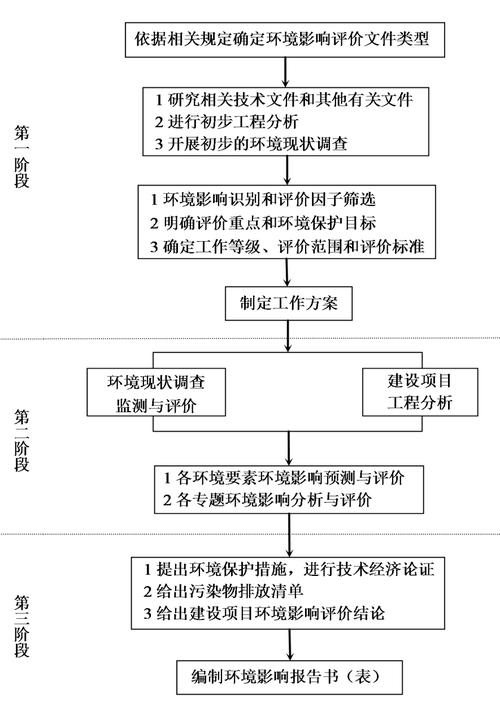
食品安全毒理学评价程序是保障食品添加剂、新食品原料、食品相关产品以及污染物等安全性科学基础的核心体系,其通过系统性的实验与数据分析,评估食品中潜在化学物质对人体健康的危害程度,为食品安全标准的制定、风险管控措施的采取提供关键依据,该程序遵循分级、分阶段、从整体到局部、体外到体内的科学原则,通常包括四个主要阶段,并结合必要的人群流行病学调查与综合评价。

第一阶段:急性毒性试验
急性毒性试验旨在初步评估受试物一次或24小时内多次给予实验动物后,短期内产生的毒性反应及死亡风险,确定其大致毒性强度和半数致死量(LD50)或半数中毒剂量(TD50),试验通常选用健康成年小鼠或大鼠,随机分为至少3-4个剂量组(含溶剂对照组)和1个阳性对照组(如已知毒物组),经口灌胃染毒,连续观察14天,记录动物的中毒症状(如活动减少、呼吸异常、抽搐、死亡等)、死亡时间及体重变化,通过统计学方法计算LD50值(即引起50%实验动物死亡的剂量),根据LD50值,受试物可划分为剧毒(LD50≤5mg/kg)、高毒(5mg/kg<LD50≤50mg/kg)、中等毒(50mg/kg<LD50≤500mg/kg)、低毒(500mg/kg<LD50≤5000mg/kg)和实际无毒(LD50>5000mg/kg)五个等级,此阶段结果为后续试验剂量设计提供基础,若LD50极低(如剧毒物质),可能需终止进一步评价;若毒性较低,则进入第二阶段试验。
第二阶段:遗传毒性试验、传统致畸试验和短期喂养试验
该阶段通过多终点试验,评估受试物的遗传毒性(潜在致癌性、致突变性)和对胚胎发育的影响,同时初步观察短期喂养的毒性靶器官。
-
遗传毒性试验:通常包括Ames试验(鼠伤寒沙门氏菌回复突变试验,检测基因突变)、骨髓细胞微核试验(检测染色体损伤)和睾丸染色体畸变试验(检测生殖细胞突变),必要时增加哺乳动物细胞基因突变试验或体外DNA损伤试验,若三项试验中两项呈阳性,则表明受试物具有遗传毒性,可能存在致癌风险,需终止评价;若一项阳性或全部阴性,则继续后续试验。
-
传统致畸试验:选用孕鼠或孕兔,在器官发生期(妊娠第6-15天)给予受试物,剂量设为1/5 LD50、1/25 LD50和1/100 LD50,于妊娠第20天处死动物,检查胎儿的畸形情况(如外观、骨骼、内脏畸形),若出现明显剂量依赖性畸形,则判定为致畸物,需终止评价。
-
短期喂养试验:选用大鼠或小鼠,设高、中、低三个剂量组(分别为无 observed adverse effect level, NOAEL的1/10、1/30、1/100)和对照组,连续喂养28天,观察动物体重、食物利用率、血液学指标(红细胞、白细胞计数等)、生化指标(肝肾功能相关酶)及主要脏器(肝、肾、脾、胃等)的病理变化,此阶段可初步确定受试物的靶器官和NOAEL,为第三阶段剂量设计提供依据。
第三阶段:亚慢性毒性试验和生殖毒性试验
亚慢性毒性试验通过较长时间的重复暴露,评估受试物对动物生长发育、生理功能及组织器官的累积毒性,通常选用大鼠或狗,喂养90天,设高、中、低三个剂量组(参考第二阶段NOAEL,高剂量组可设为1/5 LD50,低剂量组不低于人体预期摄入量的100倍),对照组给予基础饲料,观察指标包括每日体重、食物摄入量、临床症状、血液学及生化检查(肝功能、肾功能、血糖、血脂等)、脏器系数(脏器重量/体重)及病理组织学检查(重点观察肝、肾、脑、心脏等),通过数据计算亚慢性NOAEL,评估其安全系数(通常为100倍,即NOAEL/人体每日摄入量)。
生殖毒性试验包括繁殖过程(亲代交配、受孕、妊娠)、胚胎发育(胎仔生长、器官分化)和子代发育(出生后生长、行为、生殖功能)三个阶段,通常选用大鼠,设高、中、低三个剂量组,连续进行两代繁殖,观察指标包括亲代交配率、受孕率、妊娠率、胎仔存活率、畸形率,以及子代的体重、行为发育(如 reflex测试)、性成熟时间及生殖能力,此阶段旨在评估受试物对生殖过程和子代发育的影响,若生殖毒性显著,则需限制或禁止使用。
第四阶段:慢性毒性试验和致癌试验
慢性毒性试验和致癌试验是评价长期(甚至终身)暴露下受试物安全性的最终阶段,通常合并进行,选用大鼠,喂养期限为2年(大鼠生命周期),设高、中、低三个剂量组(高剂量组应能观察到明显毒性但不引起大量死亡,低剂量组不低于人体预期摄入量的50倍),对照组设阴性对照组和阳性对照组(如已知致癌物),观察指标包括生存率、体重、食物消耗量、临床症状、血液学及生化检查(每3个月一次)、尿液检查、脏器系数及病理组织学检查(全面检查所有器官,重点怀疑致癌靶器官),通过病理学检查判断受试物是否具有致癌性(如肿瘤发生率、肿瘤类型、潜伏期是否显著高于对照组)。
慢性毒性试验的NOAEL和致癌试验的结果是制定食品中化学物质残留限量(如ADI值,每日允许摄入量)的核心依据,若致癌试验阳性,则需严格限制或禁止使用;若未观察到致癌性,则根据慢性NOAEL和人群暴露量,结合安全系数(通常为100倍)制定ADI值。
特殊情况评价
除上述四个阶段外,对于某些特定物质(如转基因食品、食品添加剂复合物),还需结合代谢试验(研究受试物在体内的吸收、分布、代谢、排泄过程,明确其活性代谢产物)、人群流行病学调查(直接观察人群暴露后的健康效应,如长期摄入某种食品与疾病的关联性分析)以及结构-活性关系分析(通过化学结构推测其潜在毒性),综合评估其安全性。
相关问答FAQs
问:食品安全毒理学评价中,为何要设置多个阶段的试验?
答:多阶段试验设计遵循“由简到繁、由低风险到高风险”的科学原则,目的是在保证安全的前提下,合理利用资源,第一阶段急性毒性试验快速判断物质的急性危害,避免剧毒物质进入后续高成本试验;第二阶段遗传毒性和致畸性试验筛查潜在的致癌、致畸风险,减少对高风险物质的深入投入;第三、四阶段通过亚慢性、慢性试验逐步累积长期暴露数据,最终全面评估其安全性,这种分级设计可提高评价效率,降低伦理和经济成本。
问:毒理学试验的NOAEL值在食品安全管理中有什么意义?如何应用于制定ADI值?
答:NOAEL(未观察到有害作用剂量)是指在毒理学试验中,某种物质在特定条件下对实验动物不引起任何可观察到有害作用的最高剂量,它是确定物质安全性的关键参数,反映了物质对实验动物的安全阈值,在制定ADI值(每日允许摄入量)时,通常采用公式:ADI = NOAEL / 安全系数(SF),安全系数一般设为100,其中10种间差异(动物数据外推到人),10种内差异(个体敏感性差异),某物质的NOAEL为100mg/kg·bw,则ADI = 100 / 100 = 1mg/kg·bw,即人体每日每公斤体重摄入该物质不超过1mg时,是安全的,ADI值为食品中该物质的限量标准制定提供了科学依据。




